Hieff UNICON® ColorGPS qPCR SYBR Green Master Mix (High Rox) 是2×实时定量PCR扩增的预溶液,具有荧光强度高,灵敏度高和特异性强,扩增产量高等特点。核心组分Hieff UNICON® Taq DNA聚合酶采用抗体法热启动,可以有效抑制样品准备过程中引物退火导致的非特异性扩增。同时配方添加了提升PCR反应扩增效率因子和均衡不同GC含量(30~70%)基因扩增的促进因子,使定量PCR可以在宽广的定量区域内获得良好的线性关系。该产品利用不同染料的混合变色反应来监控移液操作,有效降低了移液误差的发生。
- 移液追踪:降低漏加/错加风险
- 扩增优异:在宽广的线性范围内有良好的线性关系
- 精准度好:可精准区分2倍浓度差异模板
- 重复性好:复孔孔间差异小,有更好的重复性
- 稳定可靠:反应体系可于常温放置24小时,产品反复冻融20次不影响
- 移液追踪,降低漏加/错加风险

移液追踪,进程清晰。使用产品按照按照说明书进行加样,其中混有不同颜色染料的模板最终投入量均为2 μL。观察显示翌圣新品移液追踪可清晰展示加样进程。注:11190ES为11188ES的High Rox版本。
- 扩增优异,动态范围内可获得可靠的结果
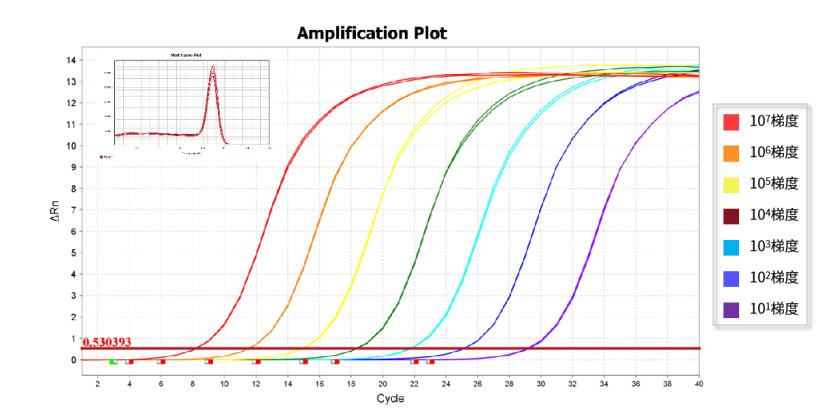
动态范围内可获得可靠的结果。以2 µL的101-107梯度的质粒为模板,扩增相关基因。Hieff UNICON® ColorGPS 预混液可有效检测7个数量级范围的模板量,在宽广的线性范围内获得良好的线性关系。注:11190ES为11188ES的High Rox版本。
- 可精准分辨2倍模板浓度差异
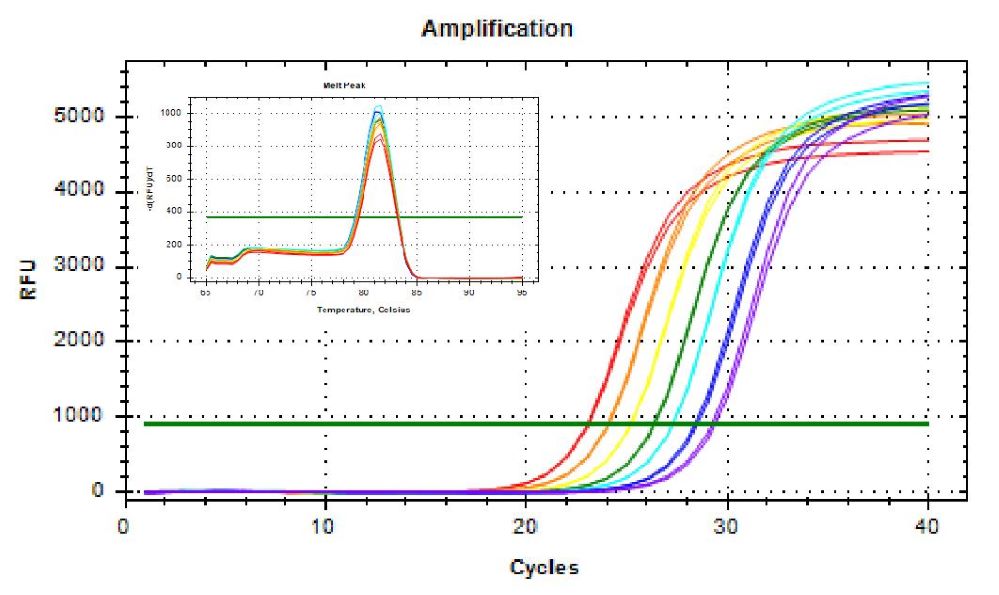
可精准分辨2倍模板浓度差异。以2 µL的质粒的2倍梯度稀释液为模板,扩增相关基因。Hieff UNICON® ColorGPS 预混液能够精准分辨模板浓度差异。注:11190ES为11188ES的High Rox版本。
- 不同类型样本基因扩增出色
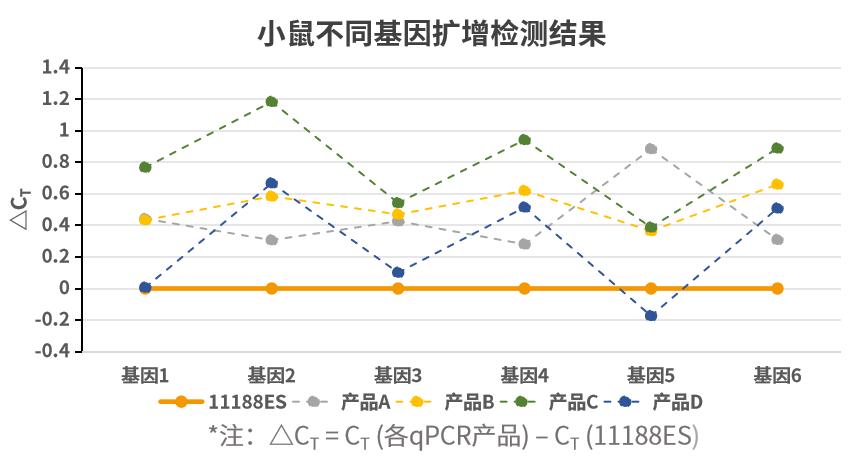
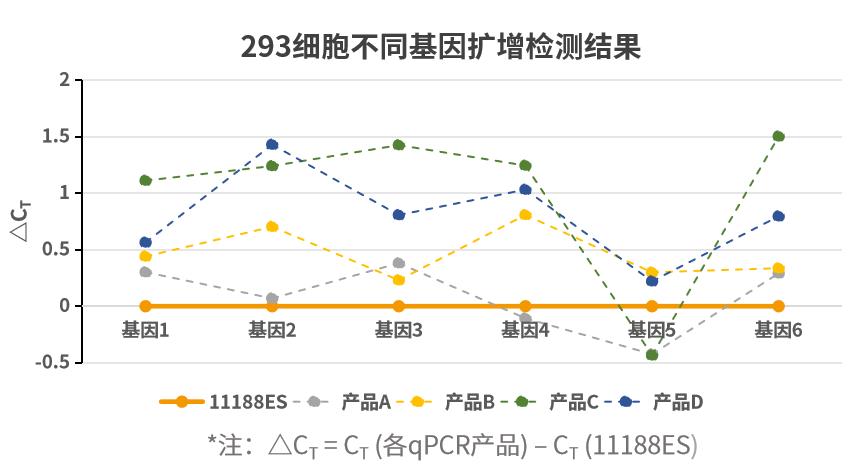
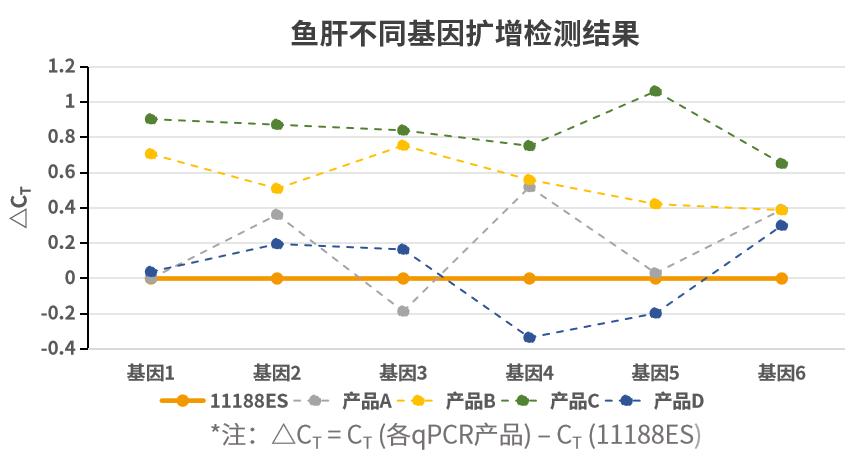
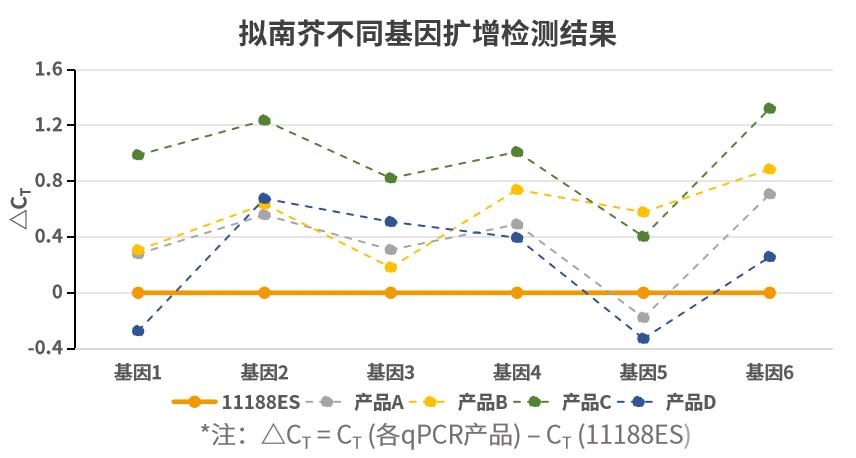
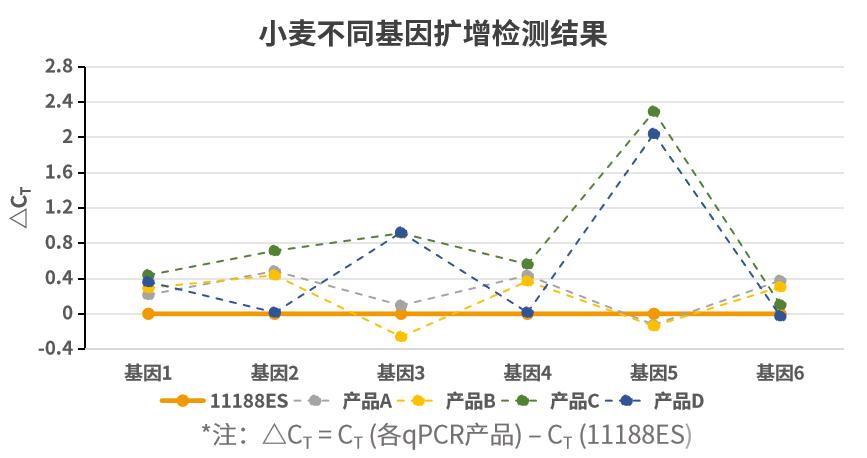
扩增不同类型样本基因,多能表现出色。以不同类型样本不同基因为靶标,使用不同荧光定量试剂按照各自说明书规定的程序进行扩增。ΔCT 值 (ΔCT = CT (各qPCR产品) – CT (11188ES))显示,新品在多数样本基因中扩增更加出色。注:11190ES为11188ES的High Rox版本。
- 重复性好
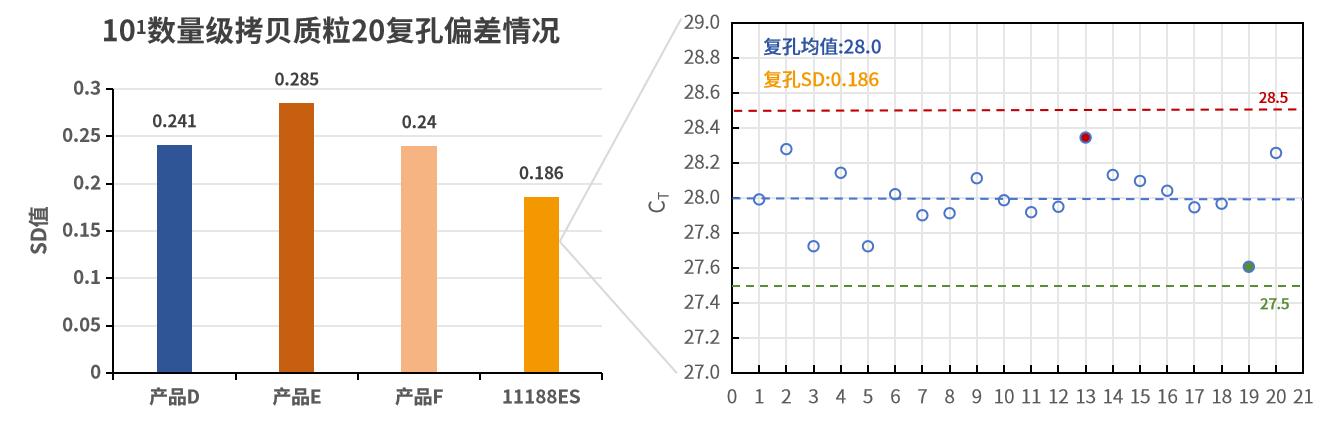
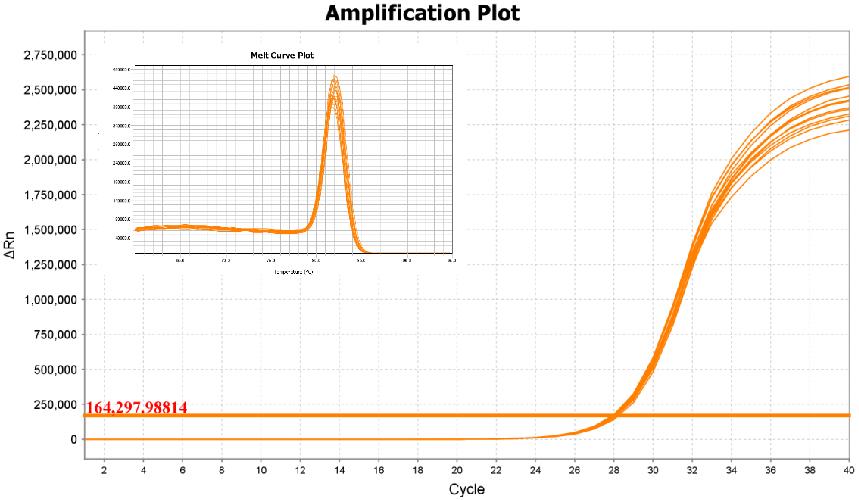
复孔孔间差异小,表现出更好的重复性。以数十个拷贝质粒为模板,使用不同荧光定量试剂按照各自说明书规定的程序进行扩增。SD值表明,相比于其他反转录试剂,新品复孔间差异更小,重复性更好。注:11190ES为11188ES的High Rox版本。
- 适用于标准或快速程序
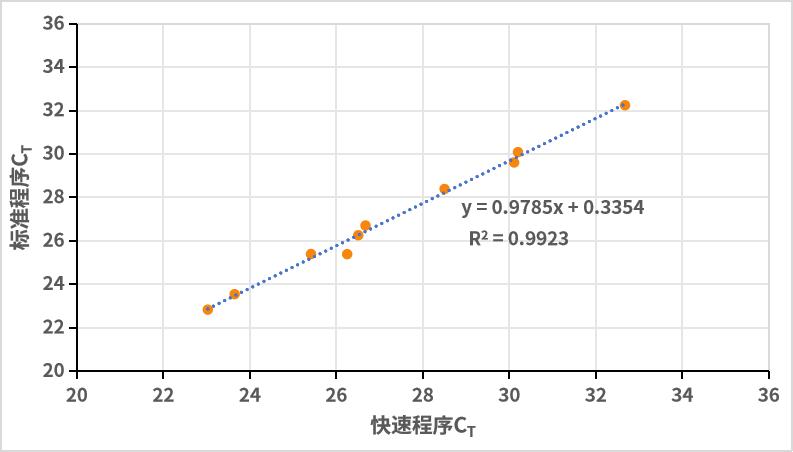
更加灵活,适用于标准或快速程序。标准程序中变性时间和延伸时间分别设置为10秒和30秒,快速程序中变性时间和延伸时间分别设置为3秒和10秒,检测10个目标基因对应的Ct值。结果显示,新品在标准和快速程序中得到的Ct值相关性强,新品使用快速程序能够获得良好的结果。注:11190ES为11188ES的High Rox版本。
- 反应体系可在室温下稳定保持24小时
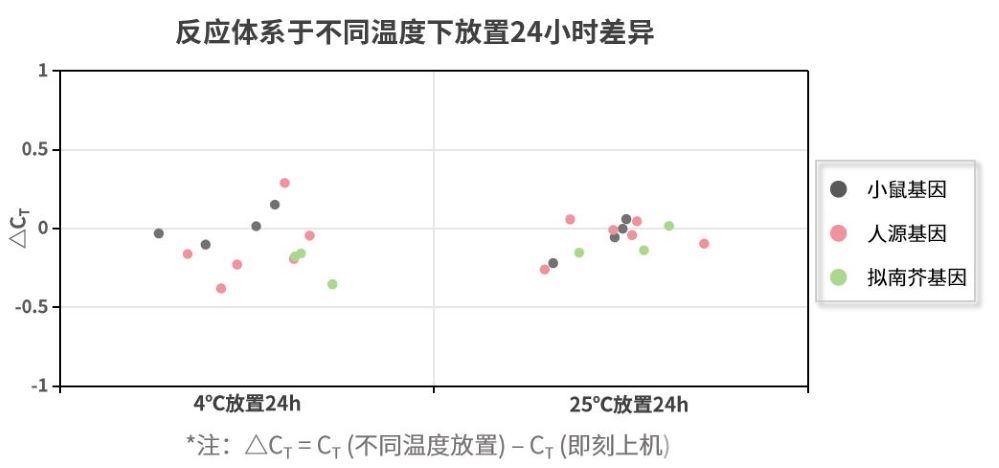
制备完反应体系后,可在室温下稳定保持24小时。分别以小鼠、人293细胞、拟南芥不同基因作为靶标,制备完反应体系后,在不同温度中避光放置24小时再进行检测。相较于即刻上机,不同基因检测差异不超过0.5个CT,表明长时间操作也可获得稳定结果。注:11190ES为11188ES的High Rox版本。
- 储存稳定可靠
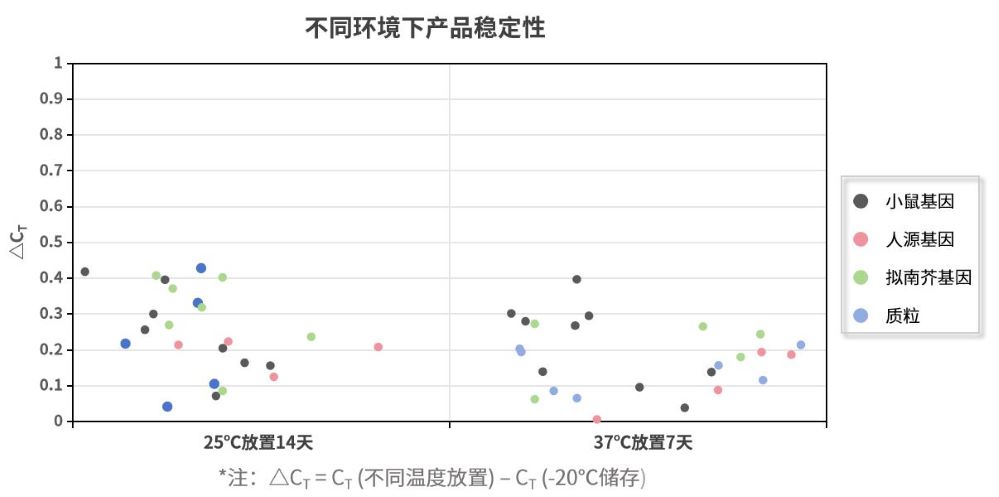
试剂于不同温度放置7或14天,仍能够保持较好的稳定性。新品分别在25℃放置14天和在37℃放置7天。以不同样本不同基因作为靶标进行扩增检测。数据显示,试剂储存稳定性好,得到的CT值相差不大,不超过0.5个CT。注:11190ES为11188ES的High Rox版本。
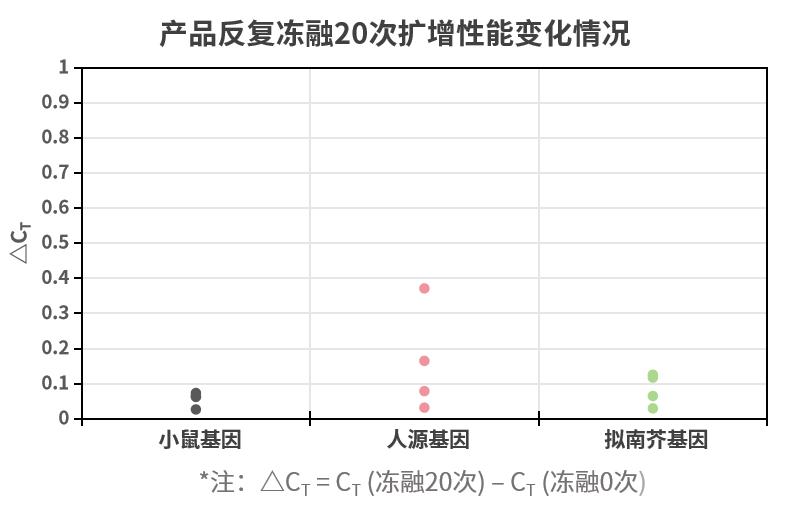
试剂反复冻融多次,仍能够保持较好的稳定性。将新品冻融20次后,分别以小鼠、人、拟南芥不同基因作为靶标进行qPCR。ΔCT 值显示,试剂反复冻融后,得到的CT值相差不大,不超过0.5个CT。注:11190ES为11188ES的High Rox版本。
-25~-15℃避光保存,有效期1年。





