 CHO残留DNA检测试剂盒——严把生物药安全关
CHO残留DNA检测试剂盒——严把生物药安全关
哺乳动物CHO细胞系是目前表达制备生物制品最广泛的宿主,在上市和临床试验生物药中,70%来自哺乳动物细胞。CHO细胞应用尤为广泛,近几年仍将继续作为生产生物制品的主要宿主细胞,例如:CHO细胞可以用来生产干扰素、白介素、EPO、单抗、诊断试剂和重组蛋白疫苗等药物。
但源自CHO细胞培养生产的这些生物制品中会含有宿主细胞杂质,包括宿主细胞的蛋白残留、DNA残留和RNA残留。其中宿主细胞残留DNA由于可能存在的免疫原性、感染性以及致瘤性等安全问题成为关键质控指标,所以各国药品监管部门都对DNA杂质进行严格限量,要求细胞表达产物的最终产品中DNA含量应尽可能低,必须采用高灵敏度的方法进行定量。
WHO和美国FDA现行指导方针推荐成品中残留DNA不高于10 ng/剂,美国FDA还指出生物制品宿主细胞DNA残留量≤100pg/剂。《中华人民共和国药典》2020年版第三部也规定,康柏西普DNA残留量≤30pg/mg,重组乙型肝炎疫苗(CHO细胞)DNA残留量应不高于10pg/剂。
基于宿主残留DNA潜在的风险,2010年 FDA 发布的相关指导原则强调对于不同的细胞系,根据其来源和遗传背景来确定残留DNA的测试,其中包括:降低生物活性来减少宿主细胞来源的 DNA的致瘤性和感染性风险;降低残留DNA含量,减小宿主残留DNA片段的大小;通过化学方法来减小残留DNA大小和降低它的生物学活性;在终产品中需要检测宿主残留DNA含量和片段大小分布情况。另外,有研究表明一个功能基因至少片段大小在 200bp 以上,故为了减少残留DNA风险,FDA 建议残留DNA片段不大于200bp。
经过归纳,各国药典中生物制品残留DNA检测方法主要有:杂交法、阈值法、荧光染料法和qPCR 法等。
其中,《美国药典》2015年颁布的新版(USP38-NF33),推荐qPCR法作为检测生物制品中宿主残留DNA的标准方法。《中华人民共和国药典》2020年版第三部也将定量PCR法加进去了。因为,qPCR法具有极高的灵敏度、序列特异性和准确性,可为生物制药工业在工艺研究和成品质量控制方面提供可靠的检测手段,现也已成为各生物制品厂家首选检测方法。
针对上述情况,翌圣生物自主研发了CHO残留DNA检测试剂盒,其能专一快速的检测抗体药、重组蛋白疫苗等生物制品研发和生产过程的中间品、半成品和成品中 DNA 残留量。还研发了与CHO残留DNA检测试剂盒配套使用的宿主细胞残留 DNA 样本前处理试剂盒,以及配套的自动化核酸提取仪器。
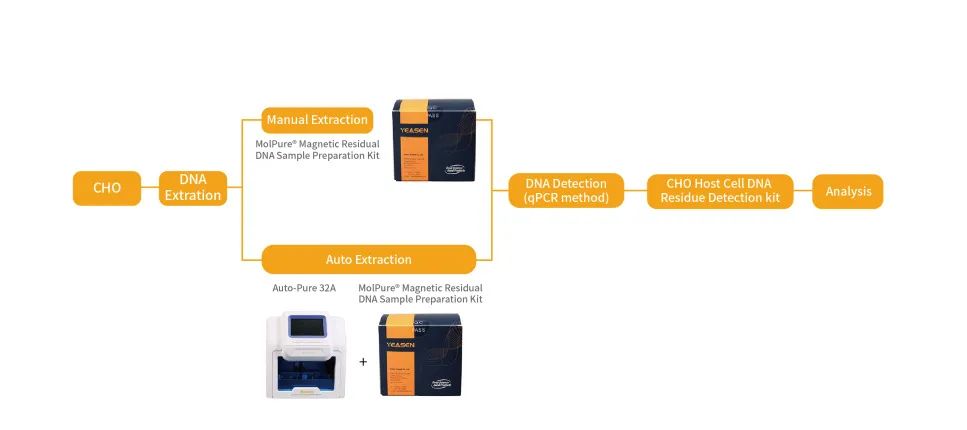
下图就宿主细胞中CHO残留DNA检测的整体实验流程,进行了详细介绍:
搭配翌圣磁珠法样本前处理试剂盒解放双手,自动化提取样本中的宿主细胞残留DNA。
对使用样本前处理试剂盒提取的样本中的残留DNA进行荧光探针q-PCR定量。
 CHO残留DNA检测试剂盒——严把生物药安全关
CHO残留DNA检测试剂盒——严把生物药安全关





 CHO残留DNA检测试剂盒——严把生物药安全关
CHO残留DNA检测试剂盒——严把生物药安全关






