产品说明书
FAQ
COA
已发表文献
产品简介
T7 High Yield RNA Synthesis Kit for Co-transcription( low dsRNA)用于共转录加帽体系,试剂盒进行了共转录反应体系的优化,使用的T7 RNA聚合酶是对野生型T7 RNA聚合酶进行了改造优化,突变得到的可以大幅度降低dsRNA含量的T7 RNA 聚合酶,以含有T7 启动子序列的线型双链DNA为模板,NTPs以及帽子类似物为底物,对启动子下游的DNA序列进行转录,高效合成带有Cap1结构的单链RNA。转录时可在底物中加入修饰的核苷酸,制备生物素或染料标记的RNA。
本试剂盒可以合成长转录本以及短转录本,以1 μg的模板投入量可以产生100-200 μg的RNA。该试剂盒使用共转录加帽策略来产生 Cap1 RNA。此外,UTP 也被 N1-Me-Pseudo UTP 取代以降低免疫原性。转录合成的RNA可用于诸如RNA结构与功能研究、RNA酶保护、探针杂交、RNAi、显微注射及体外翻译等多方面的下游应用。
产品信息
|
货号 |
10634ES10 / 10634ES50 / 10634ES60 / 10634ES70 |
|
规格 |
10 T / 50 T / 100 T / 500 T |
组分信息
|
组分编号 |
组分名称 |
10634ES10 |
10634ES50 |
10634ES60 |
10634ES70 |
|
10634-A |
T7 RNA Polymerase Mix(low dsRNA) |
20 μL |
100 μL |
200 μL |
1 mL |
|
10634-B |
10×Transcription Buffer |
20 μL |
100 μL |
200 μL |
1 mL |
|
10634-C |
ATP(100mM) |
20 μL |
100 μL |
200 μL |
1 mL |
|
10634-D |
CTP(100mM) |
20 μL |
100 μL |
200 μL |
1 mL |
|
10634-E |
GTP(100mM) |
20 μL |
100 μL |
200 μL |
1 mL |
|
10634-F |
N1-Me-Pseudo UTP(100mM) |
20 μL |
100 μL |
200 μL |
1 mL |
|
10634-G |
Control DNA Template(500ng/μL) |
5 μL |
10 μL |
20 μL |
100 μL |
|
10634-H |
DNase I (2 U/μL) |
10 μL |
50 μL |
100 μL |
500 μL |
|
10634-I |
Cap1 Analog(100mM) |
20 μL |
100 μL |
200 μL |
1 mL |
|
10634-J |
Lithium chloride solution |
300 μL |
1.5 mL |
3 mL |
15 mL |
|
10634-K |
RNase-free ddH2O |
500 μL |
2.5 mL |
5 mL |
25 mL |
储存条件
-25~-15℃保存,有效期1年。
使用说明
使用说明正文
- DNA模板制备
带有双链T7启动子的线性化质粒或PCR扩增产物都可以作为体外转录模板,模板可以用TE缓冲液或RNase free H2O溶解。
T7启动子序列: TAATACGACTCACTATAA*GG (注:A*为RNA转录的第一个碱基)
1)质粒模板
将目的DNA插入含有T7启动子的质粒载体中,然后用限制酶进行处理,待完全线性化后进行纯化。
注:
- 环状质粒由于没有有效的终止,会转录出不同长度的RNA产物,为了得到特定长度的RNA,质粒必须完全线性化。
- 质粒线性化所选限制酶需要在启动子区域右侧、插入DNA片段的下游,且在插入DNA片段中无识别位点。选择的限制酶要能形成5’突出或者平滑末端。
- 为了避免蛋白及盐离子等对体系的影响,质粒线性化后建议纯化后再作为模板进行体外转录。
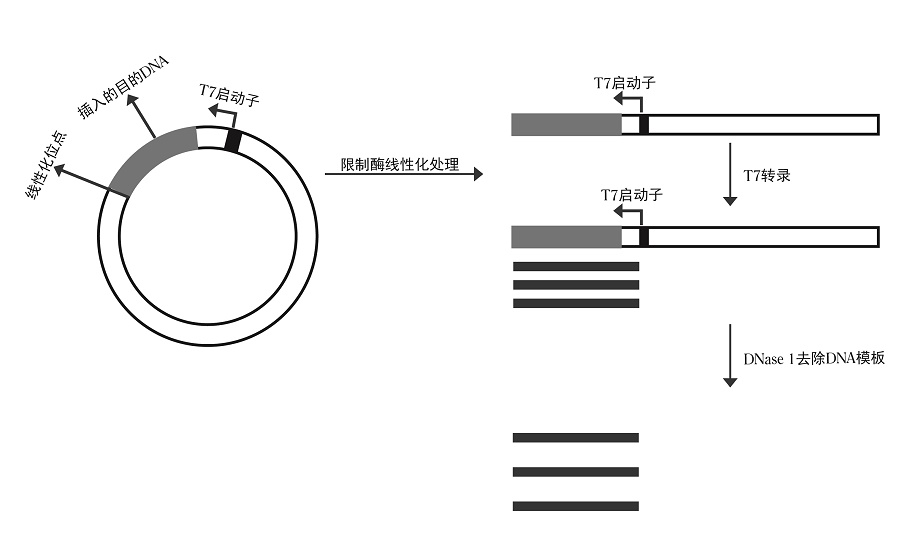
图1:线性化质粒为模板体外转录过程
2)PCR产物模板
带T7启动子的PCR产物可以作为体外转录模板。首先将T7启动子序列(TAATACGA CTCACTATAAGG)加在有义链的上游引物的5’端,然后在高保真酶的作用下扩增含T7启动子的DNA模板,随后进行转录。PCR产物可以不经纯化直接作为模板,但纯化后会得到更高的RNA产出。
注:
- PCR产物作为模板,必须电泳确认产物的特异性及浓度,建议20μL反应体系投入2-5μL PCR产物。
- 为了得到更多高品质的RNA,推荐PCR产物胶回收之后再作为模板进行体外转录。
- RNA体外转录
1)试剂解冻
将T7 RNA Polymerase Mix短暂离心,置于冰上。将除 T7 RNA Polymerase Mix外的其他所需组分解冻并振荡混匀,短暂离心收集于管底,10×Transcription Buffer置于室温,其他组分置于冰上,备用。
2)室温装配转录反应
表1 共转录RNA配制体系
|
组分 |
体积(μL) |
终浓度 |
|
RNase free H2O |
Up to 20 |
- |
|
10×Transcription Buffer |
2 |
1× |
|
CTP / GTP/ ATP/ N1-Me-Pseudo UTP (100 mM each) |
2 each |
10 mM each |
|
Cap1 Analog (100mM) |
2 |
10 mM |
|
模板DNA |
1 μg |
- |
|
T7 RNA Polymerase Mix(low dsRNA) |
2 |
- |
注:
- 反应于室温配置。由于10×Transcription Buffer中含有亚精胺,低温下亚精胺浓度过高会引起DNA模板沉淀。
- 短转录本(<100nt),模板可使用2ug,转录时间增至4-8个小时。
- 长转录本(>1000nt),建议使用质粒线性化模板进行转录。
- 建议在PCR仪中进行反应,热盖打开,防止长时间导致反应液蒸发。
- 反应产物可能有白色沉淀。这是反应过程中游离的焦磷酸与反应液中的镁离子形成焦磷酸镁,不影响后续实验。如想去除,添加EDTA即可消失。添加EDTA如果影响后续实验,也可以离心回收上清。
- 使用试剂、容器等无RNase污染。
3)37℃孵育2-3个小时
将上述反应液混合均匀,短暂离心至管底,37℃孵育2-3个小时。若转录本长度小于100nt,增加反应时间至4-8个小时。
4)DNaseⅠ处理(可选)
反应完成后,每管加入1 μL DNaseⅠ,37℃孵育15min以去除模板DNA。
- 产物纯化
转录后的RNA可以使用氯化锂沉淀法,以去除蛋白、游离的核苷酸。纯化后的RNA经电泳检测后可进行下游实验或存储于-80℃。
采用氯化锂沉淀法,RNA长度要大于300nt,且浓度不能低于100ng/μL。
- 向20μL反应混合物中,加入30μL RNase free H2O和30μL氯化锂。
- 混合均匀后,置于-20℃至少30min,以最大转速,4℃离心15min,收集沉淀。
- 加入500μL冰预冷的70%乙醇洗涤RNA沉淀。
- 用20μL RNase free H2O溶解RNA沉淀。纯化后的RNA溶液于-80℃保存。
- RNA定量
1)紫外吸收法
游离核苷酸会影响定量的准确性,采用此方法前请先进行RNA纯化。然后通过测定产物的A260读数来确定RNA的产量。对于单链RNA,1 A260相当于40µg/mL,所以RNA的产量可以如下计算: A260 x 稀释倍数 x 40 = µg/mL RNA
2)染料法
用RiboGreen染料进行RNA定量,游离核苷酸不会影响定量,可以对纯化或未纯化的反应产物中的RNA进行准确定量。
- RNA大小及质量检测
1)琼脂糖电泳法
为了确定RNA的大小,完整度以及质量,需要进行琼脂糖凝胶电泳或聚丙烯酰胺凝胶电泳进行检测。
2)Agilent Bioanalyzer检测法
可以用来评估RNA完整度及质量,它仅需要少量的RNA进行分析,高品质的RNA在电图上应呈现明显且锐利的峰。
注意事项
1. 本产品仅作科研用途。
2. 为了您的安全和健康,请穿实验服并佩戴一次性手套操作。
3. 反应体系中须严格注意不要混入RNase。
4. 实验器材(如:枪头、产品管等)注意严格使用 RNase Free用品。
Ver.CN20250122



